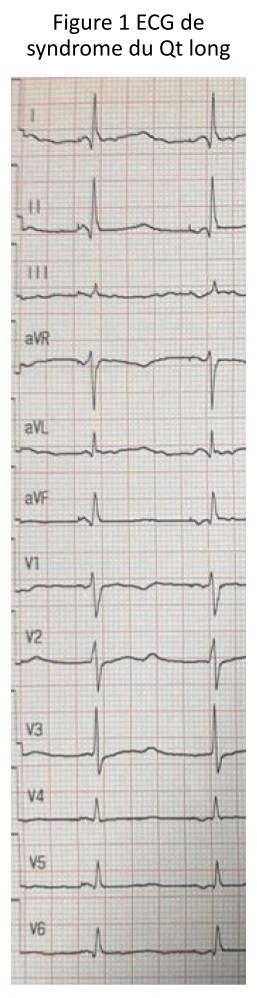
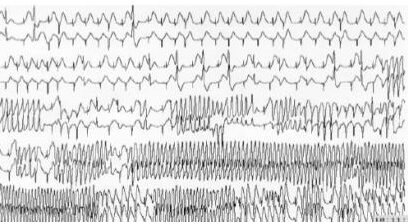
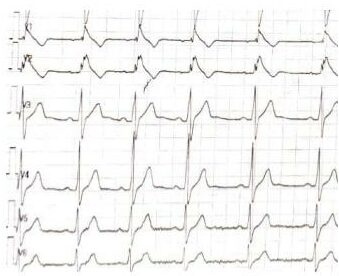
La dysplasie arythmogène du ventricule droit (DAVD) est une maladie du muscle cardiaque rare et héréditaire. La prévalence dans la population est située entre 1/1000 et 1/5000. Dans la DAVD, les cellules musculaires cardiaques normales sont progressivement remplacées par des cellules fibreuses/cicatricielles et adipeuses anormales. Cette transformation anormale favorise la survenue d’arythmies ventriculaires potentiellement graves.
Quels sont les symptômes de la DAVD ?
Les symptômes de la DAVD sont variables, on peut retrouver les symptômes suivants :
- Palpitations cardiaques (sensations de battements cardiaques rapides, irréguliers ou forts)
- Étourdissements
- Perte de connaissance (syncope)
- Douleurs thoraciques
- Essoufflement
- Fatigue
- Insuffisance cardiaque dans les stades avancés de la maladie
- Parfois elle est totalement asymptomatique
Quelles sont les causes de la DAVD ?
La DAVD est une maladie héréditaire. Elle est le résultat de mutations génétiques qui peuvent être transmises de génération en génération. Cependant, il peut également y avoir des cas sporadiques sans antécédents familiaux de la maladie.
Comment est diagnostiquée la DAVD ?
Le diagnostic de la DAVD peut être complexe et nécessite une évaluation par un cardiologue expert. La Pitié Salpêtrière est centre de référence pour la DAVD. Le diagnostic repose sur un faisceau d’arguments et plusieurs examens notamment d’imagerie,il convient de calculer un score qui permet de définir si le diagnostic de dysplasie est possible, probable ou certain. Les différents examens qui peuvent être réalisés pour le diagnostic ou le suivi sont les suivants : électrocardiogramme, échographie cardiaque, IRM cardiaque, scanner cardiaque, Holter ECG, enregistreur d’évènements implantables, épreuve d’effort, cartographie endocavitaire. Un bilan génétique est réalisé pour estimer le risque rythmique et un dépistage familial est proposé.
Prise en charge de la fibrillation atriale :
Le diagnostic et la prise en charge de la DAVD est complexe et évolutif, à la Pitié Salpêtrière les stratégies sont discutées en staff de cardiomyopathie afin de définir la stratégie la plus adaptée pour chaque patient. Dans les discussions on inclura le traitement médical, l’indication de l’implantation d’un défibrillateur, l’indication d’une ablation endocavitaire.