Les canalopathies sont des maladies cardiaques rares, associées à un risque d’arrêt cardiaque par trouble de rythme. Il n’y a pas d’anomalie morphologique du cœur associée. Elles sont principalement dues à des anomalies des canaux ioniques présents à la surface des cellules cardiaques qui sont responsables de l’activité électrique du cœur.
Les deux canalopathies les plus fréquemment rencontrées sont le syndrome de Brugada et le syndrome du QT long.
Généralités et classification
Le syndrome de Brugada a été décrit pour la première fois en 1992 par les frères Brugada et touche 5/10 000 individus.
Il se caractérise par des modifications de l’électrocardiogramme (ECG).
Les anomalies ECG caractérisant le syndrome de Brugada sont un sus décalage visible dans certaines dérivations V1 et V2 et des dérivations dites hautes V1’ et V2’ (Figure 1).
Lorsque cet aspect est visible sur l’ECG, on dit qu’il s’agit d’un type 1. Il peut être inconstant, en variant au cours de la journée, de la vie ou en fonction d’autres paramètres. Ainsi un ECG normal en consultation n’élimine pas qu’un syndrome de Brugada ait pu être vu sur un ECG précédent. Il est parfois nécessaire de réaliser un test à L’Ajmaline pour démasquer le Syndrome de Brugada : il s’agit alors d’un syndrome de Brugada type 2
Les symptômes
Les symptômes sont liés à la survenue d’événements rythmiques : perte de connaissance, malaises, apparition d’une épilepsie, rarement palpitations et sensation de tachycardie. Ces événements peuvent être nocturnes.
Un des premiers symptômes qui en fait sa gravité peut être un arrêt cardiaque ou mort subite d’origine cardiaque. Il s’agit d’une des causes principales de mort subite du sujet jeune.
Classiquement il est dit que les symptômes sont plus fréquents chez les hommes, avec un âge moyen de 40 ans, variable néanmoins et peut survenir tout au long de la vie.
Le test à l’Ajmaline
Pour démasquer le syndrome de Brugada il existe des tests pharmacologiques : le test à l’Ajmaline ou à la Flécaïne. Si le syndrome de Brugada n’est mis en évidence que par ce test on parle de syndrome de Brugada de type 2.
Ce test est réalisé couramment à la Pitié Salpêtrière en ambulatoire, en présence d’un médecin qui s’assure de l’absence de contre-indication, du bon déroulé du test et de son interprétation. Il nécessite une perfusion et une surveillance scopée. La surveillance dure quelques heures.
Si le test montre la présence d’un syndrome de Brugada, il est dit « positif ».
Ce test peut être réalisé suite à des symptômes évocateurs (perte de connaissance par exemple) ou lorsque les anomalies ECG ne sont pas typiques du syndrome de Brugada (confirmation diagnostic) ou dans le cas de bilans familiaux.
Lien vers la section dédiée ? figure possible
Aspect génétique
Le syndrome de Brugada est lié à des mutations dans certains gènes qui assurent le bon fonctionnement des canaux cellulaires.
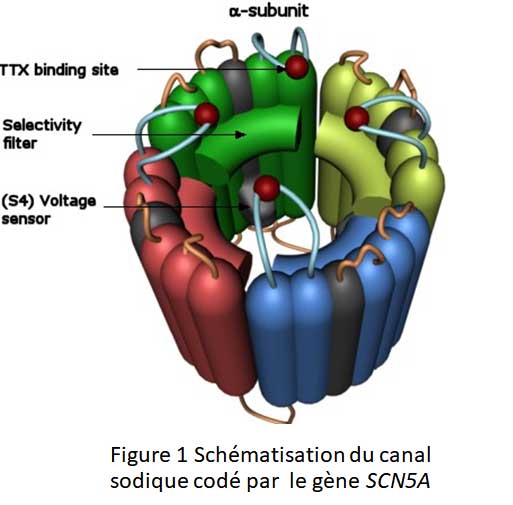
Le principal gène touché par ces mutations est SCN5A qui code pour le canal sodique (Figure 2). Or le canal peut ne dysfonctionner que dans certaines situations : non modifiables comme l’âge, le sexe ou modifiables comme la prise médicamenteuse, fièvre.
Un individu porteur d’un syndrome de Brugada est porteur d’une mutation souvent héritée sur le plan génétique, avec une variabilité d’expression (chez certains sujets bradycardie et implantation d’un pacemaker et tout le monde dans la famille ne fera pas un événement cardiaque : forme asymptomatique) ce qui fait qu’aucun antécédent familial n’est parfois connu dans la famille.
Classiquement les mutations décrites dans ce syndrome sont à transmission dite autosomique dominante : c’est-à-dire que les apparentés au 1er degré (parents, frères et sœurs, enfants) ont 50% de risque d’être porteurs de la même mutation que celui qui est porteur du syndrome de Brugada.
Il est recommandé de réaliser un bilan cardiaque dans la famille qui est orienté par le cardiologue ou le cardio-généticien.
Un test génétique est également recommandé pour orienter la surveillance dans la famille.
Prise en charge
- Chez les patients qui ont présenté un arrêt cardiaque ou une arythmie ventriculaire grave, la prise en charge comporte la mise en place d’un défibrillateur (lien vers la rubrique DAI) car il existe un risque de récidive d’arrêt cardiaque.
Selon l’appréciation de l’équipe soignante, un traitement antiarythmique peut être débuté. Dans de rares cas et selon la surveillance rythmique mise en place par le rythmologue, des procédures d’ablation sont proposées.
De plus il est recommandé l’éviction de certains médicaments majorant les risques d’événements. La liste est donnée en consultation et doit être portée par le patient en permanence.
Enfin le traitement de la fièvre est recommandé dès son apparition par la prise de paracétamol en l’absence de contre-indication
- Chez les patients asymptomatiques (découverte fortuite, apparentés, etc), le traitement est l’éviction des médicaments contre-indiqués et le traitement de la fièvre dès son apparition.
Une surveillance avec un rythmologue est proposée avec consigne de consulter plus tôt si apparition de symptômes. Au cas par cas pour évaluer le risque de mort subite une stimulation ventriculaire programmée peut être nécessaire
Généralités
Le syndrome du QT long est associé à un risque d’arrêt cardiaque par trouble du rythme cardiaque. Il s’agit d’une maladie rare qui peut toucher 1/5000 personnes d’âges variable
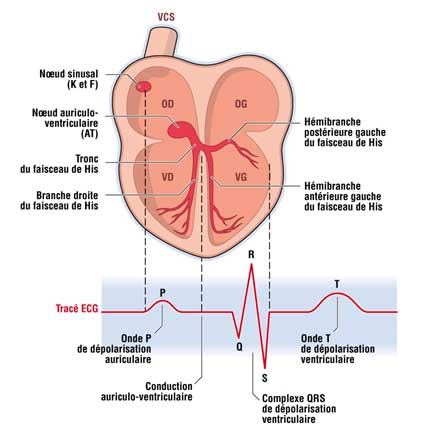
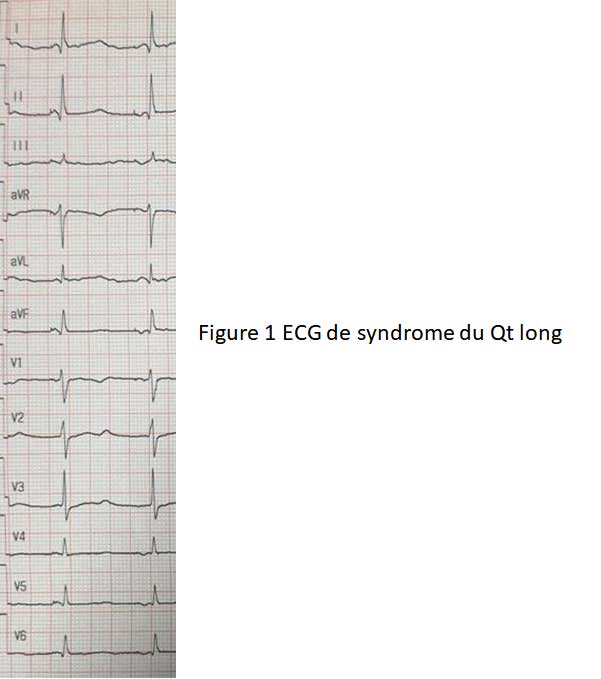
Le syndrome du QT long est caractérisé par un allongement de l’intervalle QT sur un électrocardiogramme et parfois associé à des modifications de l’onde T Figure 1.
Cet intervalle représente la repolarisation cardiaque qui est le retour à l’état de base de la cellule cardiaque sur le plan électrique. Cet intervalle peut varier au cours du temps, parfois de la journée ou lors de la prise de certains médicaments. C’est pourquoi un ECG normal n’élimine pas qu’un syndrome du QT long ait pu être diagnostiqué antérieurement.
Le diagnostic et classification
Plusieurs examens permettent le diagnostic du syndrome du QT long.
L’intervalle QT varie en fonction de la fréquence cardiaque et c’est pourquoi l’intervalle est corrigé lors de l’interprétation de l’ECG par le rythmologue : on parle de QTc. Le diagnostic peut se faire en consultation sur l’ECG mais aussi grâce à un holter ECG ou grâce à une épreuve d’effort.
Le rythmologue a parfois recours à des tests pharmacologiques : le test à l’adrénaline qui permet de poser le diagnostic.
La morphologie de l’onde T et de l’intervalle QT permet de classer les différents syndromes de QT long : type 1, type 2, type 3. Ces différents syndromes ont des caractéristiques cliniques différentes : risque d’arrêt cardiaque, facteurs déclenchants les arythmies, réponse aux traitements.
La mise en évidence des mutations génétiques associées au syndrome du QT long a permis de confirmer cette classification et de découvrir de nouveaux types de syndrome du QT long.
Les symptômes
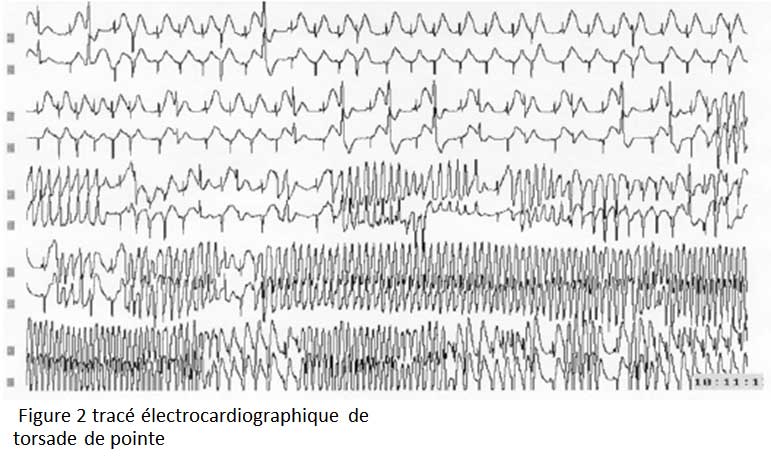
Les symptômes sont liés à la survenue d’événements rythmiques : les torsades de pointe (Figure 2) .
Ils comportent les pertes de connaissance, malaises, apparition d’une épilepsie, rarement palpitations et sensation de tachycardie.
Un des premiers symptômes qui en fait sa gravité peut être un arrêt cardiaque ou mort subite d’origine cardiaque. Il s’agit d’une des principales causes de mort subite du sujet jeune.
En fonction du type de QT long, les facteurs favorisants et la catégorie d’âge de survenue des événements est variable.
La prise en charge
La prise en charge repose sur des traitements médicamenteux (anti-arythmiques), l’implantation d’un pacemaker ou d’un défibrillateur (lien vers la rubrique correspondante) selon l’évaluation du rythmologue et les symptômes et les mesures d’éviction des facteurs déclenchants.
La prise en charge est aussi principalement dictée par la classification des syndromes du QT long (cf ci-dessus) et est discutée au cas par cas avec le rythmologue.
Dans type de QT long, la prise médicamenteuse (bétabloquants) diminue drastiquement le risque d’événement cardiaque.
L’éviction des facteurs déclenchants concernent la contre-indication aux médicaments allongeant l’intervalle QT dont il existe une liste régulièrement mise à jour.
Il est donc important que les patients portent l’information qu’ils sont porteurs d’un syndrome du QT long et le signalent à tous leurs professionnels de santé. L’éviction de certains sports peut être recommandée.
Certaines périodes de vie sont plus à risque comme la grossesse et le post partum et nécessitent une surveillance spécifique et une consultation pré-conceptionnelle ou pré-natale avec le rythmologue.
Aspects génétiques
Un individu porteur d’un syndrome du QT long est porteur d’une mutation souvent héritée sur le plan génétique, avec une variabilité d’expression : toute personne porteuse de la mutation ne fera pas un événement cardiaque : ce sont les formes asymptomatiques. C’est ce qui fait qu’aucun antécédent familial n’est parfois connu dans la famille.
Classiquement les mutations décrites dans ce syndrome sont à transmission dite autosomique dominante : c’est-à-dire que les apparentés au 1er degré (parents, frères et sœurs, enfants) ont 50% de risque d’être porteurs de la même mutation que celui qui est porteur du syndrome du QT long.
Il est recommandé de réaliser un bilan cardiaque dans la famille qui est orienté par le cardiologue ou le cardio-généticien.
Un test génétique est également recommandé pour orienter la surveillance dans la famille et pour permettre un traitement préventif.
Pour plus d’informations :